Achtung: Titel komplett oder überwiegend mit Ablauf des 25.05.2020 aufgehoben
Verordnung über das datenbankgestützte Informationssystem über Medizinprodukte des Deutschen Instituts für Medizinische Dokumentation und Information (DIMDI-Verordnung - DIMDIV)
Artikel 1 V. v. 04.12.2002 BGBl. I S. 4456; aufgehoben durch Artikel 17 Abs. 5 G. v. 28.04.2020 BGBl. I S. 960, 1018
Geltung ab 01.01.2003; FNA: 7102-47-9 Genehmigungs- und überwachungsbedürftige Anlagen
| |
Geltung ab 01.01.2003; FNA: 7102-47-9 Genehmigungs- und überwachungsbedürftige Anlagen
| |
§ 1 Anwendungsbereich
Diese Verordnung regelt die Verarbeitung der Daten, die für das datenbankgestützte Informationssystem über Medizinprodukte benötigt werden.
§ 2 Elektronische Anzeigen, Anträge und Unterrichtungen
(1) Anzeigen nach den §§ 25 und 30 Absatz 2 des Medizinproduktegesetzes sind im Wege der Datenübertragung über das zentrale Erfassungssystem bei dem Deutschen Institut für Medizinische Dokumentation und Information nach den Anlagen zu dieser Verordnung vorzunehmen.
(2) Absatz 1 gilt entsprechend für
- 1.
- Anzeigen nach § 18 Absatz 3 Nummer 1, § 22c Absatz 1 sowie § 23a des Medizinproduktegesetzes sowie nach § 8 Absatz 2 Satz 1 der Verordnung über klinische Prüfungen von Medizinprodukten,
- 2.
- Anträge nach § 22 Absatz 1 Satz 1, § 22a Absatz 1 Satz 1, § 22c Absatz 2 und § 24 des Medizinproduktegesetzes sowie nach § 7 Absatz 1 und § 8 Absatz 2 Satz 4 der Verordnung über klinische Prüfungen von Medizinprodukten.
(2a) Zur Übermittlung von Unterrichtungen aus dem datenbankgestützten Informationssystem im Rahmen der Verfahren nach den Absätzen 1 und 2 halten die Beteiligten die elektronischen Postfächer empfangsbereit, die gegenüber dem Deutschen Institut für Medizinische Dokumentation und Information für den Austausch im Informationssystem benannt wurden. Unterrichtungspflichten innerhalb des Informationssystems gelten als erfüllt, wenn die Unterrichtung an das entsprechende elektronische Postfach versendet wurde.
(3) Für die Bezeichnung von Medizinprodukten ist eine vom Deutschen Institut für Medizinische Dokumentation und Information mittels des zentralen Erfassungssystems vorgegebene Nomenklatur zu verwenden. Die technischen Modalitäten der Datenerfassung und -übermittlung veröffentlicht das Deutsche Institut für Medizinische Dokumentation und Information auf seiner Internetseite.
Text in der Fassung des Artikels 5 Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften V. v. 25. Juli 2014 BGBl. I S. 1227 m.W.v. 29. Juli 2014
§ 3 Zentrales Erfassungssystem zur Entgegennahme von Anzeigen nach dem Medizinproduktegesetz
(1) Beim Deutschen Institut für Medizinische Dokumentation und Information werden die Voraussetzungen dafür geschaffen, Anzeigen nach § 18 Abs. 3 Nr. 1, §§ 25 und 30 Abs. 2 des Medizinproduktegesetzes zentral über ein internetbasiertes Erfassungssystem für die zuständigen Behörden entgegenzunehmen. Die Anzeigen werden durch ein automatisiertes Verfahren den zuständigen Behörden zugeordnet und diese werden unverzüglich über den Eingang der Anzeige informiert.
(2) Die zuständigen Behörden prüfen die nach § 2 Absatz 1 und 2 Nummer 1 eingestellten Daten auf Plausibilität und sorgen für die notwendige Vervollständigung.
(3) Nach Abschluss der Prüfung nach Absatz 2 gibt die zuständige Behörde die Daten gegenüber dem Deutschen Institut für Medizinische Dokumentation und Information zur Einstellung in eine der in § 4 Abs. 1 benannten Datenbanken frei. Mit der Freigabe gilt die Übermittlungspflicht der Behörde an das Deutsche Institut für Medizinische Dokumentation und Information nach dem Medizinproduktegesetz als erfüllt. Die zuständige Behörde soll den Anzeigepflichtigen nach Absatz 1 über die Datenfreigabe informieren.
Text in der Fassung des Artikels 1 Erste Verordnung zur Änderung der DIMDI-Verordnung V. v. 10. Mai 2010 BGBl. I S. 542 m.W.v. 13. Mai 2010
§ 3a Zentrales Erfassungssystem für Anzeigen und Anträge bei klinischen Prüfungen und Leistungsbewertungsprüfungen
(1) § 3 Absatz 1 gilt entsprechend für Anzeigen und Anträge nach § 22 Absatz 1 Satz 1, § 22a Absatz 1 Satz 1, § 22c Absatz 1 und 2 sowie der §§ 23a und 24 des Medizinproduktegesetzes sowie nach § 7 Absatz 1 und § 8 Absatz 2 der Verordnung über klinische Prüfungen von Medizinprodukten, die bei der zuständigen Bundesoberbehörde und der zuständigen Ethik-Kommission vorzunehmen und zu stellen sind.
(2) Die zuständige Bundesoberbehörde und die zuständige Ethik-Kommission geben ihre Entscheidungen zu Anträgen nach Absatz 1 unverzüglich in die Datenbank nach § 4 Absatz 1 Nummer 3 ein. Mit der Eingabe ihrer Entscheidung in die Datenbank hat die zuständige Ethik-Kommission die Unterrichtungspflicht nach § 22 Absatz 4 Satz 2 des Medizinproduktegesetzes erfüllt.
(3) In einem automatisierten Verfahren werden die Behörden, die für die Überwachung zuständig sind, über Entscheidungen nach Absatz 2 Satz 1 informiert.
Text in der Fassung des Artikels 1 Erste Verordnung zur Änderung der DIMDI-Verordnung V. v. 10. Mai 2010 BGBl. I S. 542 m.W.v. 13. Mai 2010
§ 4 Medizinprodukte-Datenbanken
(1) Das Deutsche Institut für Medizinische Dokumentation und Information betreibt folgende Datenbanken:
- 1.
- Datenbank mit den Inhalten der Anlagen 1 und 2 zu dieser Verordnung über
- a)
- Anzeigen nach § 25 des Medizinproduktegesetzes und
- b)
- Anzeigen nach § 30 Abs. 2 des Medizinproduktegesetzes,
- 2.
- Datenbank mit dem Inhalt der Anlage 3 zu dieser Verordnung über Bescheinigungen der Benannten Stellen nach § 18 Abs. 3 Nr. 1 des Medizinproduktegesetzes,
- 3.
- Datenbank mit dem Inhalt der Anlage 4 zu dieser Verordnung über klinische Prüfungen und Leistungsbewertungsprüfungen nach den §§ 20 bis 24 des Medizinproduktegesetzes,
- 4.
- Datenbank mit dem Inhalt der Anlage 5 zu dieser Verordnung über Mitteilungen zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu anderen Produkten nach § 33 Abs. 2 Nr. 2 in Verbindung mit § 13 des Medizinproduktegesetzes,
- 5.
- Datenbanken zum Medizinprodukte-Beobachtungs- und -Meldesystem mit den Daten nach § 29 Absatz 1 Satz 5 des Medizinproduktegesetzes; sie enthalten die Informationen über
- a)
- Meldungen zu Vorkommnissen und Rückrufen gemäß § 3 Absatz 1 bis 4 der Medizinprodukte-Sicherheitsplanverordnung, den Abschluss und das Ergebnis der durchgeführten Risikobewertungen sowie die Mitteilungen, die die zuständigen Bundesoberbehörden nach § 21 Absatz 1 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung übermitteln oder nach § 21 Absatz 2 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung erhalten, und
- b)
- Meldungen zu schwerwiegenden unerwünschten Ereignissen während klinischer Prüfungen oder Leistungsbewertungsprüfungen von In-vitro-Diagnostika gemäß § 3 Absatz 6 der Medizinprodukte-Sicherheitsplanverordnung sowie den Abschluss und das Ergebnis der durchgeführten Risikobewertungen.
(2) Das Deutsche Institut für Medizinische Dokumentation und Information kann national und international zugängliche Datenbanken, die Informationen über Medizinprodukte enthalten, zur Nutzung aufbereiten und bereitstellen.
Text in der Fassung des Artikels 5 Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften V. v. 25. Juli 2014 BGBl. I S. 1227 m.W.v. 29. Juli 2014
§ 5 Nutzung der Datenbanken
(1) Neben dem Bundesministerium der Verteidigung und dem Bundesministerium für Gesundheit sind die für das Medizinprodukterecht, das Atomrecht, das Strahlenschutzrecht und das Eich- und Messwesen zuständigen Behörden des Bundes und der Länder berechtigt, Daten aus den Datenbanken nach § 4 Absatz 1 entgeltfrei abzurufen, soweit dies zur Wahrnehmung ihrer Aufgaben beim Vollzug des Medizinprodukterechts erforderlich ist.
(2) Die Benannten Stellen sind berechtigt, die Datenbanken nach
- 1.
- § 4 Absatz 1 Nummer 1 Buchstabe a,
- 2.
- § 4 Absatz 1 Nummer 2 in Bezug auf eingeschränkte, verweigerte, ausgesetzte, wieder eingesetzte, zurückgezogene, gefälschte oder durch den Hersteller gekündigte Bescheinigungen und
- 3.
- § 4 Absatz 1 Nummer 5 Buchstabe a, soweit Vorkommnisse mit Produkten betroffen sind, zu denen sie eine Bescheinigung ausgestellt haben,
(3) Die nach § 22 Absatz 1 des Medizinproduktegesetzes zuständigen Ethik-Kommissionen und die nach § 3 Absatz 1 Satz 4 der Verordnung über klinische Prüfungen von Medizinprodukten beteiligten Ethik-Kommissionen sind berechtigt, die Datenbanken nach § 4 Absatz 1 Nummer 3 und 5 Buchstabe b entgeltfrei zu nutzen, soweit dies zur Wahrnehmung ihrer Aufgaben beim Vollzug des Medizinproduktegesetzes erforderlich ist.
(4) Die Datenbanken nach § 4 Absatz 1 Nummer 1 Buchstabe a und Absatz 2 sind öffentlich.
Text in der Fassung des Artikels 8 Verordnung zur weiteren Modernisierung des Strahlenschutzrechts V. v. 29. November 2018 BGBl. I S. 2034, 2021 I S. 5261; zuletzt geändert durch Artikel 1 V. v. 08.10.2021 BGBl. I S. 4646 m.W.v. 31. Dezember 2018
§ 6 Datenschutz und Datensicherheit
Bei der Datenübermittlung sind dem jeweiligen Stand der Technik entsprechende Maßnahmen zur Gewährleistung von Datenschutz und Datensicherheit zu treffen, die insbesondere die Vertraulichkeit und Unversehrtheit der Daten gewährleisten; im Falle der Nutzung allgemein zugänglicher Netze sind Verschlüsselungsverfahren anzuwenden.
§ 7 Speicherungsfrist
(1) Daten in der Datenbank nach § 4 Absatz 1 Nummer 1 stehen nach der Einstellung des Inverkehrbringens noch 20 Jahre in der Datenbank zur Verfügung. Nach Ablauf dieser Frist werden die Daten gelöscht.
(2) Daten in den Datenbanken nach § 4 Absatz 1 Nummer 2 bis 5 stehen nach der letzten Änderung des jeweiligen Datensatzes noch 20 Jahre in der Datenbank zur Verfügung. Nach Ablauf dieser Frist werden die Daten gelöscht.
Text in der Fassung des Artikels 5 Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften V. v. 25. Juli 2014 BGBl. I S. 1227 m.W.v. 29. Juli 2014
§ 8 Auskunftsrecht
Artikel 15 der Verordnung (EU) 2016/679 des Europäischen Parlaments und des Rates vom 27. April 2016 zum Schutz natürlicher Personen bei der Verarbeitung personenbezogener Daten, zum freien Datenverkehr und zur Aufhebung der Richtlinie 95/46/EG (Datenschutz-Grundverordnung) (ABl. L 119 vom 4.5.2016, S. 1; L 314 vom 22.11.2016, S. 72) ist für juristische Personen entsprechend anzuwenden.
§ 9 (aufgehoben)
Text in der Fassung des Artikels 4 Gesetz zur Änderung medizinprodukterechtlicher und anderer Vorschriften G. v. 14. Juni 2007 BGBl. I S. 1066 m.W.v. 30. Juni 2007
§ 10 (aufgehoben)
Text in der Fassung des Artikels 4 Gesetz zur Änderung medizinprodukterechtlicher und anderer Vorschriften G. v. 14. Juni 2007 BGBl. I S. 1066 m.W.v. 30. Juni 2007
Anlage 1 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG






Text in der Fassung des Artikels 5 Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften V. v. 25. Juli 2014 BGBl. I S. 1227 m.W.v. 29. Juli 2014
Anlage 2 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG





Text in der Fassung des Artikels 5 Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften V. v. 25. Juli 2014 BGBl. I S. 1227 m.W.v. 29. Juli 2014
Anlage 3 (zu § 4 Absatz 1 Nummer 2) Informationen über Bescheinigungen nach § 18 MPG




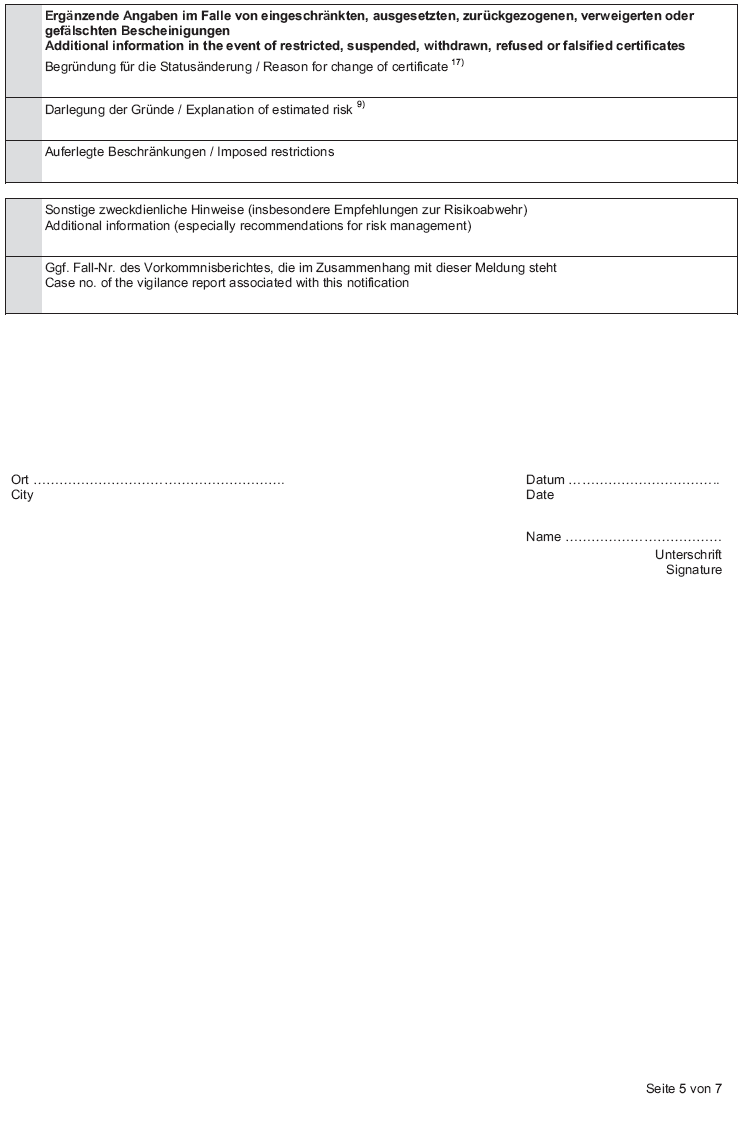


Text in der Fassung des Artikels 5 Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften V. v. 25. Juli 2014 BGBl. I S. 1227 m.W.v. 29. Juli 2014
Anlage 4 (zu § 4 Absatz 1 Nummer 3) Klinische Prüfung/Leistungsbewertungsprüfung nach den §§ 20 bis 24 MPG









Text in der Fassung des Artikels 5 Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften V. v. 25. Juli 2014 BGBl. I S. 1227 m.W.v. 29. Juli 2014
Anlage 5 (zu § 4 Absatz 1 Nummer 4) Mitteilung zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu Nicht-Medizinprodukten




Text in der Fassung des Artikels 5 Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften V. v. 25. Juli 2014 BGBl. I S. 1227 m.W.v. 29. Juli 2014
Anlage 6 (aufgehoben)
Text in der Fassung des Artikels 4 Gesetz zur Änderung medizinprodukterechtlicher und anderer Vorschriften G. v. 14. Juni 2007 BGBl. I S. 1066 m.W.v. 30. Juni 2007
Anzeige
Link zu dieser Seite: https://www.buzer.de/gesetz/4916/index.htm
Menü: Normalansicht
| Start
| Suchen
| Sachgebiete
| Aktuell
| Verkündet
| Web-Plugin
| Über buzer.de
| Qualität
| Kontakt
| Werbung
| Datenschutz, Impressum
informiert bleiben: Änderungsalarm | Web-Widget | RSS-Feed
informiert bleiben: Änderungsalarm | Web-Widget | RSS-Feed
