Tools:
Update via:
Verordnung über die Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften (MPAVEV k.a.Abk.)
Eingangsformel 1)
Auf Grund des § 37 Absatz 2, 2a, 3, 4, 5, 7 und 8 in Verbindung mit Absatz 11 des Medizinproduktegesetzes, dessen Absätze 2, 3, 4 und 8 zuletzt durch Artikel 145 Nummer 4 Buchstabe a der Verordnung vom 31. Januar 2006 (BGBl. I S. 2407) geändert, Absatz 2a durch Artikel 1 Nummer 25 Buchstabe a des Gesetzes vom 29. Juli 2009 (BGBl. I S. 2326) eingefügt, Absatz 5 zuletzt durch Artikel 1 Nummer 25 Buchstabe b des Gesetzes vom 29. Juli 2009 (BGBl. I S. 2326) geändert, Absatz 7 zuletzt durch Artikel 11 Nummer 10 Buchstabe c des Gesetzes vom 19. Oktober 2012 (BGBl. I S. 2192) geändert und Absatz 11 zuletzt durch Artikel 145 Nummer 4 Buchstabe b der Verordnung vom 31. Oktober 2006 (BGBl. I S. 2407) geändert worden sind, und in Verbindung mit § 1 Absatz 2 des Zuständigkeitsanpassungsgesetzes vom 16. August 2002 (BGBl. I S. 3165) und dem Organisationserlass vom 17. Dezember 2013 (BGBl. I S. 4310) verordnet das Bundesministerium für Gesundheit im Einvernehmen mit dem Bundesministerium für Wirtschaft und Energie und dem Bundesministerium des Innern:
---
---
- 1)
- Notifiziert gemäß der Richtlinie 98/34/EG des Europäischen Parlaments und des Rates vom 22. Juni 1998 über ein Informationsverfahren auf dem Gebiet der Normen und technischen Vorschriften und der Vorschriften für die Dienste der Informationsgesellschaft (ABl. L 204 vom 21.07.1998, S. 37), zuletzt geändert durch Artikel 26 Absatz 2 der Verordnung (EU) Nr. 1025/2012 des Europäischen Parlaments und des Rates vom 25. Oktober 2012 (ABl. L 316 vom 14.11.2012, S. 12).
Artikel 1 Verordnung zur Regelung der Abgabe von Medizinprodukten
Artikel 1 ändert mWv. 29. Juli 2014 MPAV
Artikel 2 Änderung der Medizinprodukte-Betreiberverordnung
Artikel 2 wird in 2 Vorschriften zitiert und ändert mWv. 29. Juli 2014 MPBetreibV § 3, § 4, § 5, § 13, mWv. 1. Oktober 2015 § 4, § 10, § 13, Anlage 3 (neu)
Die Medizinprodukte-Betreiberverordnung in der Fassung der Bekanntmachung vom 21. August 2002 (BGBl. I S. 3396), die zuletzt durch Artikel 4 des Gesetzes vom 29. Juli 2009 (BGBl. I S. 2326) geändert worden ist, wird wie folgt geändert:
- 1.
- Die §§ 3 und 4 werden wie folgt gefasst:
„§ 3 Instandhaltung von Medizinprodukten(1) Die Instandhaltung von Medizinprodukten umfasst insbesondere Instandhaltungsmaßnahmen und die Instandsetzung. Instandhaltungsmaßnahmen sind insbesondere Inspektionen und Wartungen, die erforderlich sind, um den sicheren und ordnungsgemäßen Betrieb der Medizinprodukte fortwährend zu gewährleisten. Die Instandhaltungsmaßnahmen sind unter Berücksichtigung der Angaben des Herstellers durchzuführen, der diese Angaben dem Medizinprodukt beizufügen hat. Die Instandsetzung umfasst insbesondere die Reparatur zur Wiederherstellung der Funktionsfähigkeit.(2) Der Betreiber darf mit der Instandhaltung nur Personen, Betriebe oder Einrichtungen beauftragen, die- 1.
- auf Grund ihrer Ausbildung und praktischen Tätigkeit über die erforderliche Sachkenntnis verfügen und
- 2.
- über die erforderlichen Mittel, insbesondere Räume, Geräte und sonstigen Arbeitsmittel zur ordnungsgemäßen Ausführung dieser Aufgabe, verfügen
(3) Nach der Instandhaltung nach Absatz 1 müssen die für die Sicherheit und Funktionstüchtigkeit der Medizinprodukte wesentlichen konstruktiven und funktionellen Merkmale geprüft werden, soweit sie durch die Maßnahmen beeinträchtigt werden können.(4) Die durch den Betreiber mit den Prüfungen nach Absatz 3 beauftragten Personen, Betriebe oder Einrichtungen müssen die Voraussetzungen nach Absatz 2 erfüllen und bei der Durchführung und Auswertung der Prüfungen in ihrer fachlichen Beurteilung weisungsunabhängig sein.
§ 4 Aufbereitung von Medizinprodukten(1) Die Aufbereitung von bestimmungsgemäß keimarm oder steril zur Anwendung kommenden Medizinprodukten ist unter Berücksichtigung der Angaben des Herstellers mit geeigneten validierten Verfahren so durchzuführen, dass der Erfolg dieser Verfahren nachvollziehbar gewährleistet ist und die Sicherheit und Gesundheit von Patienten, Anwendern oder Dritten nicht gefährdet wird. Dies gilt auch für Medizinprodukte, die vor der erstmaligen Anwendung desinfiziert oder sterilisiert werden.(2) Eine ordnungsgemäße Aufbereitung nach Absatz 1 Satz 1 wird vermutet, wenn die gemeinsame Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention am Robert Koch-Institut und des Bundesinstitutes für Arzneimittel und Medizinprodukte zu den Anforderungen an die Hygiene bei der Aufbereitung von Medizinprodukten beachtet wird. Die Fundstelle wird vom Bundesministerium für Gesundheit im Bundesanzeiger bekannt gemacht.
abweichendes Inkrafttreten am 01.10.2015
- (3) Für die Aufbereitung von Medizinprodukten mit besonders hohen Anforderungen an die Aufbereitung („Kritisch C") gemäß der Empfehlung nach Absatz 2 ist die Zertifizierung des Qualitätsmanagementsystems durch eine von der nach dem Dritten Abschnitt des Gesetzes über Medizinprodukte zuständigen Behörde anerkannten Stelle Voraussetzung.
Ende abweichendes Inkrafttreten
- (4) § 3 Absatz 2 gilt entsprechend."
- 2.
- Dem § 5 wird folgender Absatz 4 angefügt:„(4) Absatz 2 gilt nicht für in der Anlage 1 aufgeführte Medizinprodukte, die nach der Kennzeichnung, der Gebrauchsanweisung oder den Werbematerialien durch den Personenkreis nach § 3 Nummer 15 des Medizinproduktegesetzes zur Anwendung durch Laien vorgesehen sind. Einweisungspflichten nach anderen Vorschriften werden hiervon nicht berührt."
abweichendes Inkrafttreten am 01.10.2015
- 3.
- § 10 wird wie folgt gefasst:
„§ 10 Besondere Pflichten bei implantierbaren Medizinprodukten(1) Die für die Implantation verantwortliche Person hat unverzüglich nach Abschluss der Implantation eines in der Anlage 3 aufgeführten Medizinproduktes dem Patienten folgende Dokumente auszuhändigen:- 1.
- eine schriftliche Information, die
- a)
- in allgemein verständlicher Weise die für die Sicherheit des Patienten nach der Implantation notwendigen Verhaltensanweisungen einschließlich der Maßnahmen, die bei einem Vorkommnis mit dem Medizinprodukt zu treffen sind, enthält und
- b)
- Hinweise zu erforderlichen Kontrolluntersuchungen enthält, sowie
- 2.
- einen Implantatpass, der mindestens die folgenden Daten enthält:
- a)
- Vor- und Zuname des Patienten,
- b)
- Bezeichnung, Art und Typ sowie Loscode oder die Seriennummer des Medizinproduktes,
- c)
- Name oder Firma des Herstellers des Medizinproduktes,
- d)
- Datum der Implantation und
- e)
- Name der verantwortlichen Person und der Einrichtung, die die Implantation durchgeführt hat.
(2) Der Betreiber einer Einrichtung, in der die in Anlage 3 genannten Medizinprodukte implantiert werden, hat die Dokumentation zu diesen Implantaten, mit der Patienten im Falle von korrektiven Maßnahmen nach der Medizinprodukte-Sicherheitsplanverordnung eindeutig identifiziert und erreicht werden können, so aufzubewahren, dass der betroffene Patientenkreis innerhalb von drei Werktagen über den Typ und die Chargen- oder Seriennummer des Implantates sowie über den Namen des Verantwortlichen nach § 5 des Medizinproduktegesetzes ermittelt werden kann. Die Aufzeichnungen sind für die Dauer von 20 Jahren nach der Implantation aufzubewahren; danach sind sie unverzüglich zu vernichten.(3) Kann der Patient über die Dokumentation gemäß Absatz 2 nicht erreicht werden, kann die Einrichtung unter Angabe der Krankenversicherungsnummer die Übermittlung der für die Kontaktaufnahme erforderlichen Daten des Patienten von seiner Krankenkasse verlangen."
Ende abweichendes Inkrafttreten
- 4.
- § 13 wird wie folgt geändert:
- a)
- Die Nummern 2 und 3 werden durch die folgenden Nummern 2, 2a und 3 ersetzt:
abweichendes Inkrafttreten am 01.10.2015
- 3.
- ohne Zertifizierung nach § 4 Absatz 3 ein dort genanntes Medizinprodukt aufbereitet,".
- b)
- Nummer 10 wird durch folgende Nummern 10 und 10a ersetzt:
- 5.
- Folgende Anlage 3 wird angefügt:
„Anlage 3 (zu § 10 Absatz 1 und 2)- 1.
- Aktive implantierbare Medizinprodukte
- 2.
- Nachfolgende implantierbare Produkte:
- 2.1
- Herzklappen
- 2.2
- nicht resorbierbare Gefäßprothesen und -stützen
- 2.3
- Gelenkersatz für Hüfte oder Knie
- 2.4
- Wirbelkörperersatzsysteme und Bandscheibenprothesen
- 2.5
- Brustimplantate".
Ende abweichendes Inkrafttreten
Artikel 3 Änderung der Verordnung über klinische Prüfungen von Medizinprodukten
Die Verordnung über klinische Prüfungen von Medizinprodukten vom 10. Mai 2010 (BGBl. I S. 555) wird wie folgt geändert:
- 1.
- In § 3 Absatz 2 Nummer 3 werden nach dem Wort „Bewertung" die Wörter „einschließlich des zugrunde liegenden wissenschaftlichen Erkenntnismaterials" eingefügt.
- 2.
- In § 7 Absatz 2 Nummer 3 werden vor dem Punkt am Ende ein Komma und die Wörter „es sei denn, es handelt sich um eine klinische Prüfung nach Absatz 1 Nummer 3" eingefügt.
Artikel 4 Änderung der Medizinprodukte-Sicherheitsplanverordnung
Artikel 4 wird in 2 Vorschriften zitiert und ändert mWv. 29. Juli 2014 MPSV § 3, § 5, § 7, § 12, § 20, § 22, mWv. 1. Oktober 2015 § 16, Anlage
Die Medizinprodukte-Sicherheitsplanverordnung vom 24. Juni 2002 (BGBl. I S. 2131), die zuletzt durch Artikel 3 der Verordnung vom 10. Mai 2010 (BGBl. I S. 555) geändert worden ist, wird wie folgt geändert:
- 1.
- § 3 wird wie folgt geändert:
- a)
- Absatz 5 wird durch die folgenden Absätze 5 und 6 ersetzt:„(5) Der Prüfer oder der Hauptprüfer hat dem Sponsor jedes schwerwiegende unerwünschte Ereignis zu melden.(6) Der Sponsor hat schwerwiegende unerwünschte Ereignisse der zuständigen Bundesoberbehörde zu melden. Dies gilt auch, wenn sie außerhalb von Deutschland aufgetreten sind. Wird eine klinische Prüfung auch in anderen Vertragsstaaten des Abkommens über den Europäischen Wirtschaftsraum durchgeführt, hat der Sponsor den dort zuständigen Behörden ebenfalls Meldung über in Deutschland aufgetretene schwerwiegende unerwünschte Ereignisse zu erstatten."
- b)
- Der bisherige Absatz 6 wird Absatz 7 und in Satz 1 werden die Wörter „Absätzen 1 bis 5" durch die Wörter „Absätzen 1 bis 4 und 6" ersetzt.
- 2.
- § 5 Absatz 2 wird wie folgt gefasst:„(2) Die Meldungen und Mitteilungen nach § 3 Absatz 2 bis 5 und 6 Satz 3 haben unverzüglich zu erfolgen. Dies gilt auch für Meldungen von schwerwiegenden unerwünschten Ereignissen, für die ein Zusammenhang mit dem zu prüfenden Medizinprodukt, einem Vergleichsprodukt oder den in der klinischen Prüfung angewandten therapeutischen oder diagnostischen Maßnahmen oder den sonstigen Bedingungen der Durchführung der klinischen Prüfung nicht ausgeschlossen werden kann. Alle anderen schwerwiegenden unerwünschten Ereignisse sind vollständig zu dokumentieren und in zusammenfassender Form vierteljährlich oder auf Aufforderung der zuständigen Bundesoberbehörde zu melden."
- 2a.
- In § 7 Absatz 2 Satz 1 wird die Angabe „§ 3 Absatz 1 und 5" durch die Angabe „§ 3 Absatz 1 und 6" ersetzt.
- 3.
- § 12 Absatz 4 wird wie folgt gefasst:„(4) Anwender, Betreiber und Prüfer haben dafür Sorge zu tragen, dass Medizinprodukte und Probematerialien, die im Verdacht stehen, an einem Vorkommnis beteiligt zu sein oder ein schwerwiegendes unerwünschtes Ereignis verursacht zu haben, nicht verworfen werden, bis die Untersuchungen abgeschlossen sind."
abweichendes Inkrafttreten am 01.10.2015
- 4.
- § 16 Absatz 1 und 2 wird durch folgenden Wortlaut ersetzt:
„Der in § 3 Absatz 2, 3 und 5 genannte Personenkreis hat an den korrektiven Maßnahmen entsprechend den Maßnahmenempfehlungen mitzuwirken, die der Verantwortliche nach § 5 des Medizinproduktegesetzes eigenverantwortlich oder auf Anordnung der zuständigen Behörde herausgegeben hat. Dies gilt für Maßnahmenempfehlungen des Sponsors der klinischen Prüfung oder Leistungsbewertungsprüfung entsprechend."
Ende abweichendes Inkrafttreten
- 5.
- § 20 Absatz 1 Satz 1 Nummer 2 wird wie folgt gefasst:
- „2.
- die für den Sitz des Sponsors oder seines Vertreters nach § 20 Absatz 1 Satz 4 Nummer 1a des Medizinproduktegesetzes oder, sofern diese ihren Sitz nicht in Deutschland haben, die für die Prüfstellen in Deutschland sowie die für den Ort des schwerwiegenden unerwünschten Ereignisses zuständige oberste Landesbehörde oder die von dieser benannte zuständige Behörde über eingehende Meldungen von schwerwiegenden unerwünschten Ereignissen, über den Abschluss und das Ergebnis der durchgeführten Risikobewertung."
- 6.
- § 22 Absatz 2 wird wie folgt gefasst:„(2) Die zuständige Bundesoberbehörde unterrichtet das Bundesministerium der Verteidigung, die zuständige Behörde nach § 15 des Medizinproduktegesetzes sowie die in der Vorkommnismeldung angegebene Benannte Stelle über eingehende Meldungen von Vorkommnissen und Rückrufen sowie über den Abschluss und das Ergebnis der durchgeführten Risikobewertungen. Die Unterrichtung kann auch durch Gewährung des Zugriffs auf die Daten erfolgen, die dem Deutschen Institut für Medizinische Dokumentation und Information gemäß § 29 Absatz 1 Satz 4 des Medizinproduktegesetzes zur zentralen Verarbeitung und Nutzung übermittelt worden sind."
abweichendes Inkrafttreten am 01.10.2015
- 7.
- Die Anlage zu § 16 Absatz 2 Satz 1 wird aufgehoben.
Ende abweichendes Inkrafttreten
Artikel 5 Änderung der DIMDI-Verordnung
Artikel 5 wird in 2 Vorschriften zitiert und ändert mWv. 29. Juli 2014 DIMDIV § 2, § 4, § 5, § 7, Anlage 1, Anlage 2, Anlage 3, Anlage 4, Anlage 5
Die DIMDI-Verordnung vom 4. Dezember 2002 (BGBl. I S. 4456), die zuletzt durch Artikel 1 der Verordnung vom 10. Mai 2010 (BGBl. I S. 542) geändert worden ist, wird wie folgt geändert:
- 1.
- § 2 wird wie folgt geändert:
- a)
- Die Überschrift wird wie folgt gefasst:
„§ 2 Elektronische Anzeigen, Anträge und Unterrichtungen". - b)
- Nach Absatz 2 wird folgender Absatz 2a eingefügt:„(2a) Zur Übermittlung von Unterrichtungen aus dem datenbankgestützten Informationssystem im Rahmen der Verfahren nach den Absätzen 1 und 2 halten die Beteiligten die elektronischen Postfächer empfangsbereit, die gegenüber dem Deutschen Institut für Medizinische Dokumentation und Information für den Austausch im Informationssystem benannt wurden. Unterrichtungspflichten innerhalb des Informationssystems gelten als erfüllt, wenn die Unterrichtung an das entsprechende elektronische Postfach versendet wurde."
- 2.
- § 4 Absatz 1 Nummer 5 wird wie folgt gefasst:
- „5.
- Datenbanken zum Medizinprodukte-Beobachtungs- und -Meldesystem mit den Daten nach § 29 Absatz 1 Satz 5 des Medizinproduktegesetzes; sie enthalten die Informationen über
- a)
- Meldungen zu Vorkommnissen und Rückrufen gemäß § 3 Absatz 1 bis 4 der Medizinprodukte-Sicherheitsplanverordnung, den Abschluss und das Ergebnis der durchgeführten Risikobewertungen sowie die Mitteilungen, die die zuständigen Bundesoberbehörden nach § 21 Absatz 1 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung übermitteln oder nach § 21 Absatz 2 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung erhalten, und
- b)
- Meldungen zu schwerwiegenden unerwünschten Ereignissen während klinischer Prüfungen oder Leistungsbewertungsprüfungen von In-vitro-Diagnostika gemäß § 3 Absatz 6 der Medizinprodukte-Sicherheitsplanverordnung sowie den Abschluss und das Ergebnis der durchgeführten Risikobewertungen."
- 3.
- § 5 wird wie folgt gefasst:
„§ 5 Nutzung der Datenbanken(1) Neben dem Bundesministerium der Verteidigung und dem Bundesministerium für Gesundheit sind die für das Medizinprodukterecht, das Atomrecht und das Eich- und Messwesen zuständigen Behörden des Bundes und der Länder berechtigt, Daten aus den Datenbanken nach § 4 Absatz 1 entgeltfrei abzurufen, soweit dies zur Wahrnehmung ihrer Aufgaben beim Vollzug des Medizinprodukterechts erforderlich ist.(2) Die Benannten Stellen sind berechtigt, die Datenbanken nach- 1.
- § 4 Absatz 1 Nummer 1 Buchstabe a,
- 2.
- § 4 Absatz 1 Nummer 2 in Bezug auf eingeschränkte, verweigerte, ausgesetzte, wieder eingesetzte, zurückgezogene, gefälschte oder durch den Hersteller gekündigte Bescheinigungen und
- 3.
- § 4 Absatz 1 Nummer 5 Buchstabe a, soweit Vorkommnisse mit Produkten betroffen sind, zu denen sie eine Bescheinigung ausgestellt haben,
(3) Die nach § 22 Absatz 1 des Medizinproduktegesetzes zuständigen Ethik-Kommissionen und die nach § 3 Absatz 1 Satz 4 der Verordnung über klinische Prüfungen von Medizinprodukten beteiligten Ethik-Kommissionen sind berechtigt, die Datenbanken nach § 4 Absatz 1 Nummer 3 und 5 Buchstabe b entgeltfrei zu nutzen, soweit dies zur Wahrnehmung ihrer Aufgaben beim Vollzug des Medizinproduktegesetzes erforderlich ist.(4) Die Datenbanken nach § 4 Absatz 1 Nummer 1 Buchstabe a und Absatz 2 sind öffentlich." - 4.
- § 7 wird wie folgt gefasst:
„§ 7 Speicherungsfrist(1) Daten in der Datenbank nach § 4 Absatz 1 Nummer 1 stehen nach der Einstellung des Inverkehrbringens noch 20 Jahre in der Datenbank zur Verfügung. Nach Ablauf dieser Frist werden die Daten gelöscht.(2) Daten in den Datenbanken nach § 4 Absatz 1 Nummer 2 bis 5 stehen nach der letzten Änderung des jeweiligen Datensatzes noch 20 Jahre in der Datenbank zur Verfügung. Nach Ablauf dieser Frist werden die Daten gelöscht." - 5.
- Die Anlagen 1 bis 5 erhalten die aus dem Anhang zu dieser Verordnung ersichtliche Fassung.
Artikel 6 Inkrafttreten, Außerkrafttreten
(1) Diese Verordnung tritt vorbehaltlich des Absatzes 2 am Tag nach der Verkündung*) in Kraft. Gleichzeitig treten die Verordnung über die Verschreibungspflicht von Medizinprodukten in der Fassung der Bekanntmachung vom 21. August 2002 (BGBl. I S. 3393), die zuletzt durch Artikel 2 der Verordnung vom 26. Mai 2014 (BGBl. I S. 598) geändert worden ist, und die Verordnung über Vertriebswege für Medizinprodukte vom 17. Dezember 1997 (BGBl. I S. 3148), die zuletzt durch Artikel 382 der Verordnung vom 31. Oktober 2006 (BGBl. I S. 2407) geändert worden ist, außer Kraft.
(2) Am 1. Oktober 2015 treten in Kraft: in Artikel 2 Nummer 1 § 4 Absatz 3, Artikel 2 Nummer 3, in Artikel 2 Nummer 4 Buchstabe a Nummer 3, Artikel 2 Nummer 4 Buchstabe b, Artikel 2 Nummer 5 und Artikel 4 Nummer 4 und 7.
---
- *)
- Anm. d. Red.: Die Verkündung erfolgte am 28. Juli 2014.
Schlussformel
Der Bundesrat hat zugestimmt.
Der Bundesminister für Gesundheit
Hermann Gröhe
Der Bundesminister für Gesundheit
Hermann Gröhe
Anhang zu Artikel 5 Nummer 5
Anlage 1 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG






Anlage 2 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG





Anlage 3 (zu § 4 Absatz 1 Nummer 2) Informationen über Bescheinigungen nach § 18 MPG




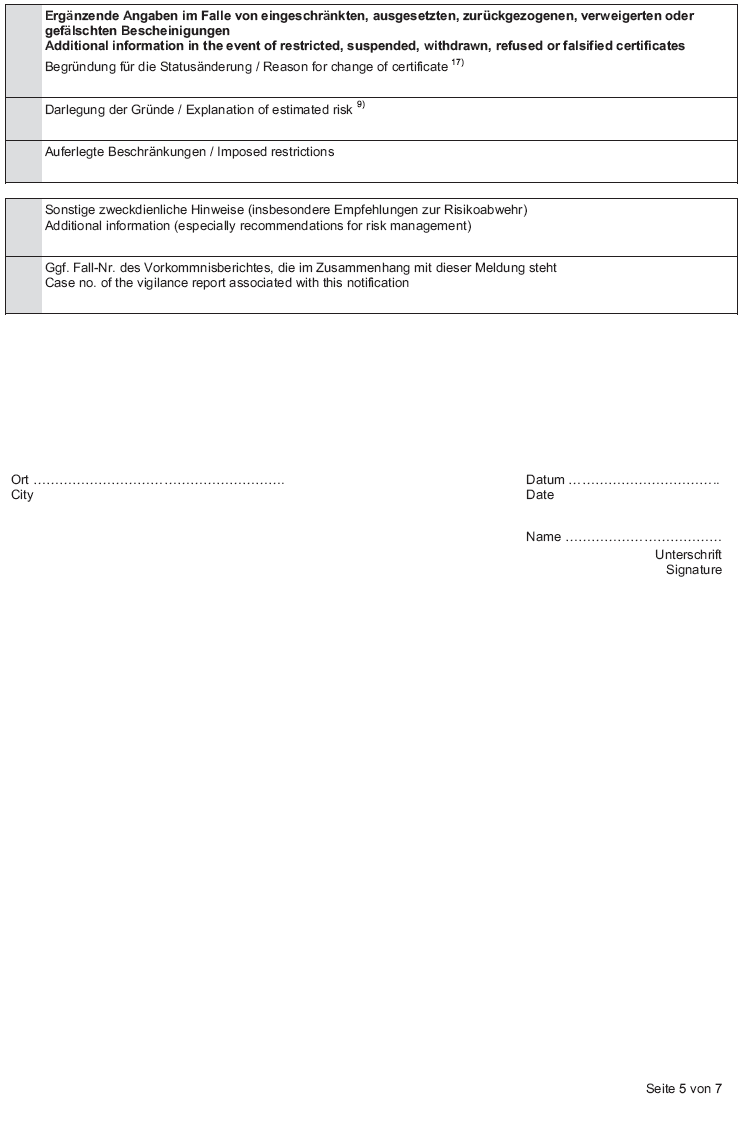


Anlage 4 (zu § 4 Absatz 1 Nummer 3) Klinische Prüfung/Leistungsbewertungsprüfung nach den §§ 20 bis 24 MPG









Anlage 5 (zu § 4 Absatz 1 Nummer 4) Mitteilung zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu Nicht-Medizinprodukten










Anlage 2 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG





Anlage 3 (zu § 4 Absatz 1 Nummer 2) Informationen über Bescheinigungen nach § 18 MPG







Anlage 4 (zu § 4 Absatz 1 Nummer 3) Klinische Prüfung/Leistungsbewertungsprüfung nach den §§ 20 bis 24 MPG









Anlage 5 (zu § 4 Absatz 1 Nummer 4) Mitteilung zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu Nicht-Medizinprodukten




Link zu dieser Seite: https://www.buzer.de/gesetz/11243/index.htm
